Un enseignant peut adopter tout au long de sa carrière diverses croyances concernant les différentes théories d'apprentissage. Pour un cours, il sera plutôt de type cognitiviste, le lendemain, pour une activité, il utilisera les principes du béhaviorisme. Quoi qu'il en soit, s'il en vient un jour à privilégier le constructivisme, il devra se confronter très tôt à une idée essentielle de cette école : les conceptions des élèves. En s'intéressant aux connaissances antérieures des élèves, sous la forme d'un savoir privé et personnel, l'enseignant peut élaborer des stratégies touchant davantage les représentations (façon d'utiliser ses conceptions) que les élèves se font des différents concepts à l'étude. Ces conceptions se divisent en deux genres. D'abord, les conceptions initiales, qui habitent l'élève avant l'enseignement formel (scolaire). Ensuite, les conceptions alternatives, qui constituent des conceptions initiales modifiées, mais qui ne sont pas en accord avec le savoir officiel. Il est important de souligner ici que ce ne sont pas des conceptions erronées (on attribue un sens péjoratif à cette expression), mais des conceptions qui, bien qu'elles soient intéressantes et fonctionnelles pour l'élève, ne sont pas exactement ce qui est accepté dans la communauté (scientifique ici). Le but de ce travail est de se familiariser avec le domaine des conceptions, plus particulièrement des conceptions des élèves touchant un concept bien précis d'une discipline d'enseignement, et de se sensibiliser à la problématique résultant de ces mêmes conceptions. Pour ce faire, nous tracerons d'abord les grandes lignes de la problématique envisagée et nous exposerons le cadre théorique relié à la recherche. Par la suite, nous décrirons en détail la méthodologie utilisée pour le travail et nous présenterons les résultats obtenus. Enfin, une discussion suivra afin de valider notre recherche. Lors d'un travail précédent(Bélanger et Verreault, 2000)1 portant sur la transposition et la reconceptualisation, nous avions choisi le concept de la mole. Nous nous souvenions avoir eu des problèmes avec cette notion; en particulier, l'un d'entre nous n'avait rien compris lors d'un premier enseignement (en sciences physiques 436). Pourtant, en effectuant le travail à l'aide de plusieurs manuels scolaires, le concept ne semblait pas poser de problèmes particuliers et le membre concerné ne comprenait pas pourquoi il avait eu tant de difficultés à comprendre ce concept qu'il a pourtant maîtrisé si facilement pas la suite. N'étant pas satisfaits d'un seul traitement pour un sujet qui semble si important, nous avons voulu pousser encore plus loin notre étude. C'est pourquoi le concept de mole a encore été choisi pour ce travail sur les conceptions. Il va sans dire que cette étude portera sur les conceptions alternatives reliées à la mole, c'est-à-dire, comme on l'a vu plus haut, sur les conceptions qui se forment après un enseignement, puisque l'on ne peut avoir de conceptions initiales (avant un enseignement formel) de la mole, car ce concept n'est pas utilisé dans la vie courante. En cherchant dans la documentation (revues portant sur l'enseignement des sciences) pour trouver des études qui traitent de ce sujet, nous avons été étonnés de voir que la mole est et a toujours été un concept très étudié de part le monde. Certains textes trouvés ne portaient que sur les utilisations judicieuses que l'on doit en faire et sur les conditions qui semblent plus avantageuses pour introduire le concept (entre autres pour les calculs et les expériences de laboratoire). D'autres textes portaient sur les problèmes reliés à l'identification de termes qui ne semblent pas être utilisés au Québec, par exemple g-atome, g-molécule, gmol, lbmol, etc. En effet, ces expressions sont surtout utilisées dans les textes anglophones américains. Enfin, il restait une troisième catégorie de textes, beaucoup plus restreinte, traitant des problèmes de compréhension du concept de mole. Ce sont de ces derniers textes dont nous parlerons dans la suite de ce travail. Il y a trois grandes classes de conceptions alternatives à propos de la mole chez les élèves. Premièrement, la mole est vue comme une masse et non comme une quantité. Souvent, cela est relié à l'utilisation des termes dont nous avons décidé de ne pas parler (ex : lbmol) puisqu'ils ne causent pas de problèmes au Québec. Mais il y a aussi confusion avec la masse molaire qui lui est associée et qui est enseignée juste après. Cette même masse molaire est à son tour en conflit avec la masse atomique ou moléculaire. En plus, même quand la mole est vue comme une quantité, les élèves ont de la difficulté à se représenter cette quantité. Cela tient à son ordre de grandeur et le problème est plutôt mathématique que chimique. Deuxièmement, la mole est définie comme le nombre d'Avogadro et n'est pas reliée au carbone-12. C'est sûrement là le plus gros problème de la mole selon les chercheurs spécialisés dans ce domaine. Nous y reviendrons dans la section suivante portant sur le cadre théorique puisque le problème semble créer toute une controverse dans le monde scientifique. Mais puisque le nombre d'Avogadro est important pour faire des calculs de concentration, entre autres, on doit admettre que c'est un chiffre dont les élèves se rappellent quand même facilement et qu'ils sont capables d'utiliser pour faire des calculs simples. Ce nombre est souvent présenté par analogie (comme une douzaine, par exemple) et quelquefois, on l'associe à l'expérience utilisée pour le trouver expérimentalement. Troisièmement, les propriétés des gaz reliés à la mole sont souvent étendues aux liquides et aux solides et il y a confusion à propos de l'application ou non du volume de 22,4 litres. Cette conception semble venir des problèmes reliés aux 2 autres conceptions mentionnées précédemment. Les études portant sur ce sujet sont plus vieilles et datent d'avant le début de la controverse Avogadro vs carbone-12. Les nouvelles études les plus récentes portent, elles, sur les problèmes des élèves en chimie, qui seraient reliés à la mole et à l'utilisation ou non de la définition internationalement utilisée (SI). La recherche et la lecture de documents concernant le savoir officiel nous ont beaucoup éclairées sur les descriptions des problèmes trouvés dans les revues spécialisées dans l'enseignement des sciences. En effet, dans le travail sur la reconceptualisation de la mole, nous nous étions basés sur les manuels québécois d'enseignement des sciences au secondaire. Dans TOUS ces manuels, on définit la mole comme une quantité de matière qui correspond au nombre d'Avogadro (6,022 x 1023 particules). C'est pourquoi nous avions bâti notre travail sur cette définition. À notre grand étonnement, la définition officielle de la mole, une unité SI (Système International) pour la mesure d'une quantité de substance, est toute autre. Il s'agit de la quantité de substance qui contient autant de particules qu'il y en a dans exactement 0,012 kg de carbone-12 (Lehmann, Worth & Zinder, 1988)2. Nous avons mentionné en introduction qu'un membre de l'équipe n'avait pas du tout compris le concept de mole la première fois qu'il l'avait abordé. Eh bien, nous savons maintenant pourquoi. C'est tout simplement parce que son enseignant lui avait fait aborder la mole à partir de cette définition, qui est extrêmement peu répandue. On dit même dans des études américaines que cette notion devrait être anéantie puisqu'elle détruit l'intérêt de plusieurs personnes pour la chimie. Il est intéressant de noter que les deux premières conceptions alternatives mentionnées plus haut sont relativement proches de la définition de mole qui prévalait avant la mise au point de IUPAC (International Union of Pure and Applied Chemistry) en 1957. On parlait alors d'une masse (qu'on reliait à gramme-atome ou gramme-molécule, comme il est encore vu dans certains pays) et d'une quantité de matière trouvée expérimentalement (6,022 x 1023). C'est encore ce qu'on retrouve dans la majorité des manuels scolaires partout dans le monde, selon les articles consultés, alors qu'on devrait relier fondamentalement la mole à l'échelle de l'atome ou de la molécule. En effet, c'est à partir de cela qu'on a institué la définition moderne des masses atomiques en 1961 (un atome de carbone-12 a une masse d'exactement 12 unités de masse atomique ou u.m.a.). Il n'est donc pas étonnant que les concepts qui découlent de la mole (masse molaire, concentration molaire et volume molaire) ne soient pas traités et compris comme ils devraient l'être. En n'abordant pas la définition officielle dans l'enseignement secondaire au Québec, on limite les élèves dans leurs capacités à effectuer des calculs sans avoir nécessairement besoin d'un algorithme. Et on voit pourquoi nous-mêmes, étudiants en sciences au cégep et à l'université, ne nous sommes jamais préoccupés de savoir s'il existait une autre définition de la mole. Choix des sujets 3.3 Associer le concept de la mole à une mesure de quantité de matière 3.4 Associer le concept de mole au nombre d'Avogadro. 3.5 Associer le concept de la mole à une mesure de la masse molaire d'une substance. 3.6 Préparer, par dilution, une solution aqueuse de concentration molaire donnée. Choix de l'instrument de cueillette de données Description de la technique d'investigation Déroulement des entretiens
Malgré ces directives, et probablement parce que l'enseignant habituel était absent cette journée-là, le silence ne s'est établi qu'une minute et demie après que les questionnaires aient tous été distribués. Les élèves les plus rapides ont rempli le questionnaire en 8 minutes; le moins rapide en 17 minutes. Une fois que les questionnaires ont été remplis, nous avons d'abord compilé toutes les réponses données par tous les élèves à toutes les questions du sondage. Suite à cela, nous avons bâti des catégories de réponses qui correspondaient mot à mot à ce que certains élèves avaient écrit ou aux dessins des élèves, sauf pour les catégories « autres » et « n'a pas répondu ». Pour chaque groupe, soit celui de Chimie 534 et celui de Géographie 534, nous avons recensé le nombre de réponses correspondant à chaque catégorie construite. Grâce à ce recensement, nous avons pu établir quelles conceptions les élèves ont de la mole et à quoi ils pensent que sert la mole. De plus, nous avons classé leurs conceptions de la masse molaire, des unités de la masse molaire, de la concentration molaire et des unités de la concentration molaire. Ensuite, nous avons regardé quelles sont leurs conceptions initiales du volume molaire. Finalement, nous avons jeté un coup d'œil sur le niveau de difficulté du questionnaire tel que perçu par les élèves, sur leur qualification de l'apprentissage de la mole (s'ils ont trouvé l'apprentissage difficile) et si le concept de mole a été un objectif plus ou moins difficile à atteindre par rapport aux autres concepts en chimie. Des tableaux illustrant les catégories de réponse et les recensements sont présentés dans la prochaine section. À remarquer que dans le recensement du groupe de Chimie 534 et du groupe de Géographie 534, les pourcentages affichés sont relatifs à l'effectif d'un groupe lui-même et non pas à l'addition des effectifs des deux groupes. Tableau 1. Conceptions qu'ont les élèves de la mole selon ce qu'ils ont répondu à la première question. La mole est un(e) : L'expression 2+3 signifie que l'élève croit que la mole est ce qui est défini en 2 et ce qui est défini en 3.
Tableau 2. Nombre qu'associent les élèves à la mole selon la deuxième question. (Note : pour simplifier le tableau, la notation des ingénieurs est utilisée. Par exemple, 6,0 E 23 = 6,0 X 1023)
Tableau 3. Ce à quoi les élèves croient que la mole sert selon la troisième question.
Tableau 4. Conceptions qu'ont les élèves de la notion de la masse molaire selon ce qu'ils ont écrit à la quatrième question.
Tableau 5. Unités qu'associent les élèves au concept de masse molaire selon ce qui a été écrit à la quatrième question.
Tableau 6. Conception qu'ont les élèves de la notion de concentration molaire selon ce qui a été écrit à la cinquième question.
Tableau 7. Unités qu'associent les élèves au concept de concentration molaire selon ce qui a été écrit à la cinquième question.
Tableau 8. Conceptions initiales des élèves de chimie 534 sur la notion de volume molaire selon ce qu'ils ont écrit à la sixième question.
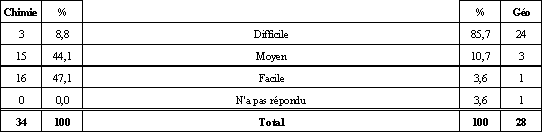
Tableau 9. Niveau de difficulté accordé au questionnaire par les élèves selon leurs réponses à la question 7 a).
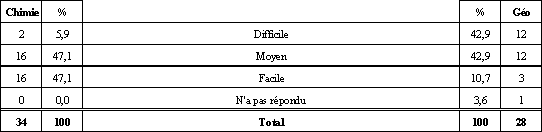
Tableau 10. Niveau de difficulté accordé par les élèves à l'apprentissage de la mole selon ce qu'ils ont répondu à la question 7 b).
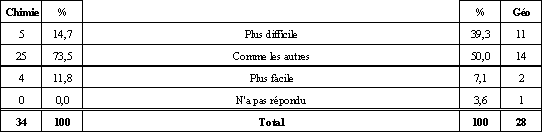 Voyons, dans cette section, ce que les élèves du groupe de Chimie 534, que nous appellerons les « chimistes », pour plus d'efficacité, et les élèves du groupe de Géographie 534, que nous appellerons les « géographes », pensent de la mole. Profitons-en aussi pour en saisir les causes et voir ce que nous en retirons. Une conception de la mole qui ne nous étonne pas chez les chimistes. Même si aucun élève ne nous a démontré qu'il avait une conception de la mole se rapprochant de la définition officielle du SI, nous ne sommes pas étonnés. La plupart croient plutôt que, la mole, c'est une quantité, un ensemble, un rassemblement ou un regroupement de particules. En effet, comme il en a été question dans le cadre théorique, tous les manuels québécois d'enseignement que nous avons consultés définissent la mole comme une quantité de matière qui correspond au nombre d'Avogadro. Probablement que les enseignants de l'institution visitée font de même ou qu'ils n'insistent pas sur la définition du SI, question de motivation. Nous croyons cependant qu'il est important que les élèves comprennent et acceptent que la définition officielle d'une mole est celle du SI, mais que la conception alternative qui fait d'elle un ensemble de 6,022 x 1023 particules est acceptable pour résoudre bien des problèmes. C'est comme la mécanique de Newton, supplantée par celle d'Einstein, mais qui sert bien pour la construction de ponts ou d'édifices. D'autre part, nous croyons intéressant de noter que les élèves n'associent pas la mole à une masse, ce qui contredit un peu les études consultées. Cela est probablement dû, comme nous en avions fait l'hypothèse, au fait que certains termes comme gramme-atome ou lbmol ne sont pas utilisés au Québec, d'où l'absence de confusion. Nous verrons plus loin si la masse molaire cause problème. Qu'ont fait les géographes de la mole? Moins de 30 % des géographes ont reconnu que la mole était soit une unité de mesure, soit un regroupement de particules. Ils associent plutôt ce concept à un atome ou à une molécule ou à d'autres réponses parfois farfelues. À vrai dire, lorsqu'on met de côté la carrière scientifique, il est bien rare que l'on ait à utiliser le concept de mole dans la vie de tous les jours. D'où l'importance de faire un retour sur ce concept avant de tenter d'augmenter le niveau de complexité. Des chimistes qui ont une bonne idée du nombre d'Avogadro, des géographes qui l'ont oublié. Encore une fois, il faut pardonner aux géographes. On n'utilise pas le nombre 6,022 x 1023 dans la vie courante, surtout qu'il est démesurément élevé. Du côté des chimistes, 100 % ont le bon ordre de grandeur parmi lesquels 80 % connaissent le chiffre exact par cœur. Comme quoi faire les travaux et les devoirs, ça compte, car c'est sûrement à force de faire des exercices qu'ils ont mémorisé ce chiffre. Une mole qui sert à calculer autant chez les géographes que chez les chimistes. Seulement 17,6 % des chimistes et 17,9 % des géographes ont classé la mole comme une unité de mesure. Effectivement, la mole faisant partie du système SI, elle peut être considérée comme une unité de mesure. La mole représente une quantité de substance qui contient autant de particules qu'il y en a dans exactement 12 g de carbone-12 tout comme le mètre représente « le trajet parcouru dans le vide par la lumière en 1/299 792 458 secondes » (Le Petit Robert, 1993)3 ou la douzaine représentant un « ensemble de douze choses de même nature » (Le Petit Robert, 1993)4. Ce qui inquiète, c'est que 74,6 % des chimistes et 46,5 % des géographes pensent que la mole sert d'abord à calculer. Pourtant, bien des élèves ont annoncé qu'ils croyaient que la mole était un regroupement d'éléments. Cela est possiblement dû au fait que le balancement d'équations et la comparaison entre divers éléments se font surtout en utilisant la mole. Et c'est ce qui donne le plus de points dans les examens. Les élèves pensent donc que la mole ne leur sert qu'au plan procédural, que pour résoudre ou balancer des équations. Il faut donc bien travailler aussi les plans concrets, abstraits et procéduraux des niveaux d'abstraction (Guilbert, 2000)5. Les chimistes définissent bien la masse molaire, mais ont moins de facilité avec ses unités. 94,1 % des élèves de chimie définissent la masse molaire comme étant la masse de 6,00 x 1023 éléments ou comme étant la masse ou le poids d'une mole de quelque chose. C'est bien satisfaisant, sauf en ce qui concerne l'emploi du terme « poids » qui représente plutôt une mauvaise conception de la différence entre la masse et le poids qu'une mauvaise conception de la masse molaire. Ce résultat si élevé provient-il du fait que l'équation n = m/M est utilisée fréquemment dans les exercices numériques portant sur la mole? Gramme, u et uma refont surface. Il est bien normal de retrouver ces unités parmi les réponses des élèves. En effet, les élèves doivent savoir depuis qu'ils font des sciences qu'une masse se mesure en gramme. Le gramme est donc une conception initiale ou alternative des unités de la masse molaire dont on peut se servir pour la complexification vers g/mol. De plus, u et uma sont des unités dont les élèves ont entendu parler sûrement avant le concept de masse molaire. D'ailleurs, on dit que la masse du carbone-12 est de 12 uma. On peut donc complexifier cette conception alternative pour la faire évoluer, via la définition officielle de la mole, vers une conception plus juste de l'unité de la masse molaire. Comment les géographes peuvent-ils bien répondre à la question portant sur la masse molaire alors qu'ils ne se souviennent plus, pour la plupart, de ce qu'est la mole? En vérité, les géographes se sont sûrement dit que la masse molaire doit être la masse d'une mole (ce qui découle d'une belle logique déductive) comme quelqu'un peut dire que la masse embryonnaire est la masse d'un embryon sans conceptualiser ce qu'est un embryon. S'ils s'étaient vraiment souvenu de ce qu'est la masse molaire, il y aurait sûrement eu plus d'un élève qui aurait été capable de donner les bonnes unités pour la masse molaire. Comment la question sur la concentration molaire peut nous permettre de savoir comment les élèves conceptualisent cette notion? Malheureusement, la forme de la question 5 serait à changer. En demandant ce que la concentration molaire a de particulier, bien des réponses sont acceptables, car nous avons omis d'indiquer par rapport à quoi elle avait quelque chose de particulier. Ainsi, la plupart des catégories de réponses étaient de bonnes réponses. Par contre, nous considérons qu'un élève qui nous a fourni de bonnes unités pour la concentration molaire a une bonne conceptualisation, à tout le moins jusqu'au niveau abstrait des niveaux d'abstraction présentés par Guilbert (2000)6. Les chimistes ont un bon niveau abstrait de conceptualisation de la concentration molaire. 85,3 % des chimistes ont donné mol/L ou M comme unité pour la concentration molaire. Au niveau abstrait, ils conceptualisent bien cette notion et il faut en tenir compte pour qu'ils développent le dernier niveau d'abstraction : le niveau discursif. Si le niveau discursif passe aussi bien, la tentation de faire de l'enrichissement ou des activités STS ou ERE devient très forte puisque 2 des 3 systèmes de perception de la tâche influençant la motivation (Goulet, 1999)7 sont déjà favorables : la perception des exigences de la tâche et la perception de la contrôlabilité de la tâche. Une bonne conception initiale du volume molaire chez les chimistes. 85,2 % des répondants ont dit que le volume molaire était soit le volume qu'occupe une mole, que le volume et le nombre de moles d'un gaz sont proportionnels, que le volume molaire est mol/cm3 ou bien que c'est le volume occupé dans 6 x 1023 unités. En partant de ces conceptions initiales, nous croyons qu'il est possible de faire évoluer les conceptions pour qu'elles se complexifient comme le savoir officiel le demande. Un questionnaire et un apprentissage du concept de mole plus difficile pour les géographes que pour les chimistes. Et c'est bien normal. Premièrement parce que les géographes travaillent hors contexte, ensuite parce les chimistes apprenaient, au moment de remplir le sondage, la loi pv = nRt. De plus, le fait que l'apprentissage ait plus souvent été classé facile par les chimistes que par les géographes est probablement dû à une motivation, à des aptitudes et à des intérêts plus grands pour les sciences de la part des chimistes que de la part des géographes. Le résultat qui montre que la plupart des élèves trouvent que le concept de la mole n'est pas plus dur ni plus facile à conceptualiser qu'un autre ne nous surprend guère. Pour beaucoup d'élèves, encore, l'école est perçue comme ayant pour but l'évaluation, ce qui ne rend pas un objectif plus ou moins attrayant qu'un autre. Limites méthodologiques Il faut bien cerner ici que nous avions affaire à une classe élite d'étudiants. Probablement que la performance aux questions n'aurait pas été la même si nous étions allés faire passer nos questionnaires dans une école avec des élèves en difficulté d'apprentissages ou ayant des conditions socio-économiques différentes. De plus, pendant que les élèves en géographie remplissaient le questionnaire dans une situation dénudée de tout contexte (sauf le contexte scolaire bien entendu), les chimistes le remplissaient alors que les concepts qu'ils tentaient d'apprendre étaient reliés à la loi des gaz parfaits (pv = nRt). Peut-être que si nous avions fait remplir notre questionnaire en début d'année scolaire, alors que les étudiants en chimie n'avaient pas retravaillé le concept de mole, les résultats auraient été différents. Sûrement que l'écart dans la performance entre les élèves en géographie et les élèves en chimie aurait été moins grand à cause surtout d'une performance plus basse des chimistes. On peut donc conclure que les conceptions alternatives concernant la mole sont souvent les mêmes, quel que soit le pays ou le degré de scolarité des élèves interrogés. Nous avions surtout travaillé avec des textes américains et italiens portant sur l'étude de sujets de niveau collégial ou universitaire, mais le constat demeure presque inchangé ici au Québec avec des élèves du secondaire. D'abord, les élèves confondent la mole avec une masse, non pas dans la définition, comme ailleurs dans le monde, mais pour ce qui est des unités. En effet, les unités de masse atomique (u.m.a) semblent entrer en interférence avec les g/mol. Peut-être aurions-nous mieux compris la difficulté si nous avions interrogé les élèves sur la masse atomique et moléculaire. Ensuite, il a été moins probant de sonder les conceptions des élèves sur le volume molaire parce que leur apprentissage n'était pas terminé, mais le concept ne semble pas causer de problème particulier. Enfin, le problème le plus fréquemment soulevé dans les études et que nous avons relevé dans ce travail, c'est la définition même de la mole. Les élèves l'associent facilement au nombre d'Avogadro et n'étudient même pas la définition officielle. Bien sûr, c'est une conception alternative qui peut fonctionner pour faire des calculs, mais quand il est temps de comprendre profondément le concept, on en arrive à des problèmes comme l'impossibilité d'associer des unités valables à la masse molaire.
Dans ce tableau, on énonce les objectifs à atteindre selon le programme existant, les conceptions alternatives trouvées dans la littérature et dans notre recherche, les obstacles que nous avons cru déduire des réponses des élèves et des pistes de solution. On voit que le décalage est grand entre les objectifs et les pistes. Il serait donc souhaitable que ces objectifs soient modifiés dans les nouveaux programmes pour mieux rendre compte des vrais enjeux de la mole. Parce que personne n'y trouve son compte, ni les « chimistes » qui ne retiennent que la vision procédurale du concept, ni les « géographes » qui en concluent que la chimie est ennuyante... BÉLANGER, M et VERREAULT, J.-S. (2000). Reconceptualisation et transposition, Université Laval, 26 p. CASE, J. M. et D. M. FRASER (1999). « An investigation into chemical engineering student's understanding of the mole and the use of concrete activities to promote conceptual change », International journal of science education, vol. 21, no 12, p. 1237-1249. CERVELLATIi, R. et al. (1982). « Investigation of secondary school student's understanding of the mole concept in Italy », Journal of chemical education, vol. 59, no 10, p. 852-856. DUNCAN, I.M. et A.H. JOHNSTON (1973). « The mole concept », Education in chemistry, vol. 10, no 6, p. 213-214. GOULET, P. (1999). Textes et travaux de cours. Apprentissage et cognition. PPG-19562. Université Laval, juin 1999, p.152-155. La troisième perception est la valeur de la tâche. GUILBERT, L. (2000).Recueil de texte Didactique des sciences II (DID-19603) Université Laval, automne 2000, p.8.2.9. KOLB, D. (1978). « Chemical principals revisited : the mole », Journal of chemical education, vol. 55, no 11, p. 728-732. KRISHNAN, S.R. et A.C. HOWE (1994). « The mole concept », Journal of chemical education, vol. 71, no 8, p. 653-655. LAZONBY, J.N. et al. (1985). « The mole : questioning format can make the difference », Journal of chemical education, vol. 62, no 1, p. 60-61. LEHMANN, WORTH & ZINDER (1988). Traduction libre de la définition de IUPAC et IFCC. STAVER, J.R. et A.T. LUMPE (1993). « A content analysis of the presentation of the mole concept in chemistry textbooks », Journal of research in science teaching, vol. 30, no 4, p 321-337 STAVER, J.R. et A.T. LUMPE (1995). « Two investigations of student's understanding of the mole concept and its use in problem solving », Journal of research in science teaching, vol. 32, no 2, p. 177-193. Questionnaire pour identifier certaines conceptions de la mole (en pdf). 1. BÉLANGER, M et VERREAULT, J.-S. (2000). Reconceptualisation et transposition, Université Laval, 26 p. 2. Traduction libre de la définition de IUPAC et IFCC (Lehmann, Worth & Zinder, 1988) 3. Selon Le Petit Robert, 1993. 4. Ibid. 5. Guilbert, L., Recueil de texte Didactique des sciences II (DID-19603) Université Laval, automne 2000, p.8.2.9. 6. Ibid. 7. Goulet, P., Textes et travaux de cours. Apprentissage et cognition. PPG-19562. Université Laval, juin 1999, p.152-155. La troisième perception est la valeur de la tâche. | |||||||||||||||||||||


 | 
Mole : étude détaillée  |